Tipp 167:
Das Färberätsel
Artefakte können einem den letzten Nerv rauben. Aber manchmal kommt Kommissar Zufall zur Hilfe.
Eine belastbare, aussagekräftige Statistik erhält man bei wissenschaftlichen Untersuchungen nur, wenn man entsprechend viele Daten auswertet. In der Immunhistochemie erreicht man diese hohen Fallzahlen, indem man Tissue Microarrays (TMA) herstellt und analysiert. Hierbei identifiziert man mit Hilfe eines Hämatoxylin-Eosin (HE)-gefärbten Schnittes Areale aus bereits vorhandenen Paraffin-Blöcken, die für die jeweilige Studie von Interesse sind, und überführt sie anschließend mit einer Biopsie-Nadel in einen neuen Paraffin-Block.
Auf diese Weise können viele verschiedene Proben auf einem Block gesammelt und später auf einem Objektträger gefärbt werden. Dies reduziert die Anzahl der gefärbten Objektträger drastisch und erleichtert die anschließende Auswertung. Zudem kann man auf diese Weise viele Proben mit denselben Reagenzien am selben Tag unter gleichen Bedingungen färben. Hierdurch erreicht man eine optimale Vergleichbarkeit innerhalb einer großen Serie. Da die Areale, die für die Begutachtung zur Verfügung stehen, sehr klein sind (ca. 0,6 - 1,0 mm Durchmesser), ist es unerlässlich, dass der gesamte Objektträger gleichmäßig angefärbt ist.
Eigentlich Routine
Im MTLA Forschungslabor des Instituts für Pathologie und Neuropathologie des Universitätsklinikums Essen, führen wir die immunhistochemische (IH) Färbung bei TMA-Schnitten mit dem gleichen Protokoll durch, mit dem wir auch ganze Gewebeschnitte färben. Dazu entparaffinieren wir die Schnitte in Xylol mit einer absteigenden Alkoholreihe. Um die Vernetzung der Proteine durch die Formalin-Fixierung rückgängig zu machen, führen wir eine Hitzevorbehandlung (HIER= heat induced epitope retrieval) durch. Hierzu gibt es verschiedene Möglichkeiten, zum Beispiel Wasserbad, Mikrowelle oder Dampfdrucktopf mit unterschiedlichen Temperaturen und Dauer der Vorbehandlung. Auch den pH-Wert des HIER-Puffers stellt man individuell ein. Die optimalen Bedingungen testet man bei jedem neuen Antikörper neu aus.
Im konkreten Fall wählten wir eine Variante mit 20-minütigem Wasserbad in EDTA-Puffer bei pH 9,0. Die Schnitte stellten wir in eine Küvette mit vorgewärmtem HIER-Puffer in ein Wasserbad, das auf 99°C eingestellt war. Nach 20 Minuten wurden sie unter fließendem Leitungswasser abgekühlt. Anschließend überführten wir die Schnitte für den automatischen Färbeprozess mit etablierten Protokollen und Reagenzien in einen Autostainer.
Ungefärbter Rand
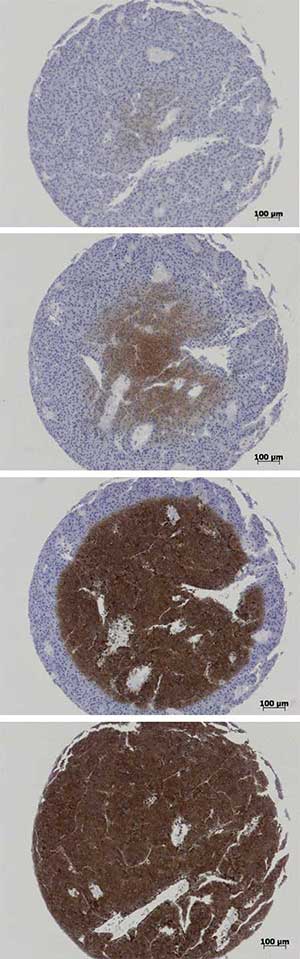
Bei der Färbung der TMA-Schnitte trat ein merkwürdiges Phänomen auf. Einzelne Gewebestanzen zeigten eine kreisförmige, zentrale Anfärbung mit ringförmigen Arealen, die komplett ungefärbt blieben. Dieser Färbeartefakt trat plötzlich und sporadisch auf, war verschieden stark ausgeprägt und hatte keine sofort erkennbare, reproduzierbare Ursache.
Um diesem merkwürdigen Färbeartefakt auf den Grund zu gehen, färbten wir zunächst unterschiedliche Primär-Antikörper auf den gleichen TMA-Schnitten. Das Erscheinungsbild war unverändert mit mehr oder weniger stark ausgeprägten Arealen, die nicht angefärbt waren. Danach tauschten wir die verwendeten Objektträger aus, um eventuelle Unregelmäßigkeiten in der Adhäsion auszuschließen. Die Färbungen mit beiden verwendeten Objektträgerarten unterschiedlicher Hersteller waren identisch.
Schließlich setzten wir den verwendeten Waschpuffer bei jeder Färbung neu an und tauschten ihn gegen den Puffer eines anderen Herstellers. Statt demineralisiertem Wasser benutzten wir Aqua dest. aus der Apotheke. Die seltsame Färbung tauchte immer noch auf.
Am Autostainer liegt‘s nicht
In unserer Verzweiflung überprüften wir den Färbeautomat auf technische Mängel. Zudem erhöhten wir das eingestellte Volumen, das auf jeden Objektträger getropft wurde um 50 µl auf 200 µl. Den Levelsensor schalteten wir aus, um zu gewährleisten, dass die Pipettiereinheit bis auf den Boden der verwendeten Reagenzgefäße herunterfährt und genug Flüssigkeit aufnimmt. Den Kompressor tauschten wir ebenfalls aus. Eine Mitarbeiterin der Herstellerfirma, die uns tatkräftig unterstützte, überprüfte alle Pipettiervorgänge mehrerer Läufe visuell.
Diese Maßnahmen sollten sicherstellen, dass alle Reagenzien gleichmäßig und in genügender Menge auf allen Schnitten pipettiert wurden, so dass das Gewebe auf keinen Fall austrocknen konnte. Wir färbten mehrere Serien an unterschiedlichen Tagen, um alle 48 Positionen auf dem Autostainer zu überprüfen. Darüber hinaus färbten wir Schnitte auf einem zweiten Autostainer in unserem Haus.
Der Erfolg war gleich null und wir konnten auch kein systematisches Muster erkennen. Demnach wies der Autostainer keinen technischen Fehler auf. Auch der Wechsel der Detektionssysteme und Enzymkonjugate (Horseradish Peroxidase (HRP) und Alkalische Phosphatase (AP)) half nichts, der Effekt trat nach wie vor in unterschiedlicher Ausprägung auf.
Auch die Wissenschaftler in Nachbar-Laboren und die Mitarbeiter der Reagenzien-Anbieter hatten keine Idee, was die Färbeartefakte verursachen könnte. Bis schließlich Laura Malkus das Färbeprotokoll etwas umstellte. Sie spülte die Schnitte nach der Hitzedemaskierung nicht mehr sofort ab, sondern ließ sie noch zehn Minuten außerhalb des Wasserbades im sich abkühlenden HIER-Puffer stehen. Anschließend ersetzte sie den HIER-Puffer vorsichtig nach und nach durch Waschpuffer. Und siehe da, der Färbeartefakt war plötzlich verschwunden.
Fortbildung mit Folgen
Eigentlich ist dieses Färbeprotokoll auch das allgemein übliche Verfahren. Nach der Fortbildung bei einem Hersteller für Immunhistochemie-Reagenzien verzichteten wir jedoch auf den zusätzlichen Abkühlungsschritt, was lange ohne merkliche Schwierigkeiten funktionierte.
Warum dieser Effekt so plötzlich und so ausgeprägt auftrat, ist uns nach wie vor ein Rätsel. Interessanterweise tauchte er ebenfalls bei Färbungen am ganzen Schnitt auf, auch hier fehlte die Färbung in Randbereichen. Da diese Areale im Vergleich zur gesamten Gewebefläche aber klein sind, fallen sie kaum auf und für eine Auswertung auch nicht ins Gewicht.
Dorothe Möllmann
Letzte Änderungen: 12.02.2013