Sind die Zellen noch ganz dicht?
Impedanz-Spektroskopie
Hans-Joachim Galla
Endothelzellen bilden in multizellulären Organismen selektive Permeabilitätsbarrieren. Sie trennen Gewebekompartimente unterschiedlicher chemischer Zusammensetzung voneinander ab und halten deren stoffliche Zusammensetzung konstant (Homöostase). Zell-Zell-Kontaktproteine (Tight Junctions), verschließen den interzellulären Spalt und kontrollieren den parazellulären Durchtritt von Molekülen. Die transzelluläre Versorgung mit Nährstoffen halten Transportproteine aufrecht, die gleichzeitig Metaboliten entsorgen.
Diese zellulären Barrieren sind keine statischen Gebilde. Ihre Durchlässigkeit ist fein reguliert und wird durch externe Stimuli moduliert. Eine wichtige Barriere ist die Blut-Hirn-Schranke, die dafür sorgt, dass das Gehirn unabhängig von der momentanen Blutzusammensetzung agieren kann. So verhindert die Blut-Hirn-Schranke zum Beispiel, dass unser Gehirn verrückt spielt, wenn wir Spargel essen und hohe Konzentrationen des darin enthaltenen Neurotransmitters Asparaginsäure im Blut zirkulieren. Die Endothelzellen der Blut-Hirn-Schranke kleiden die Kapillargefäße im Gehirn aus und trennen die Blutbahn mechanisch vom Hirngewebe.
Zell- und gewebebasierte Kulturmodelle gibt es für nahezu alle essentiellen zellulären Barrieren. Die Zellen kultiviert man auf porösen Membranen und überführt sie danach in mit Medium gefüllte Messkammern. Hieraus resultieren zwei Kompartimente, ein oberes auf der apikalen und ein unteres auf der basolateralen Seite. Die Qualität der Zellkultur wird meistens im Mikroskop morphologisch oder durch Immunfluoreszenz über die Expression der Tight-Junction-Proteine überprüft.
Dies ist aber kein direktes Maß für die Güte und Dichtigkeit der Zell-Zell-Kontakte. Hierzu sind Permeabilitätsmessungen, zum Beispiel mit radioaktiver Sucrose oder mit hydrophilen Fluoreszenzfarbstoffen nötig, die eine Quantifizierung der Barriere-Funktion erlauben. Dazu muss der Experimentator Proben ziehen und diese extern analysieren, was nur mit größerem zeitlichen und technischen Aufwand möglich ist.
Als wir (AG Hans-Joachim Galla, Institut für Biochemie im Fachbereich Chemie und Pharmazie der Universität Münster) in den neunziger Jahren mit unseren Arbeiten zur Blut-Hirn-Schranke begannen, existierte keine nicht-invasive, markierungsfreie und kontinuierlich arbeitende Analysemethode. Damals gab es nur die elektrische Widerstandsmessung mit zwei Elektrodenpaaren: eines um eine Spannung anzulegen und ein weiteres um den resultierenden Stromfluss zu messen. Der Quotient aus diesen beiden Werten ist der Ohm’sche Widerstand R (R= U/I). Dieser ist auf Grund der geringen Leitfähigkeit der Zellmembranen ein ungefähres reziprokes Maß für die ionische Leitfähigkeit über die Zell-Zell-Kontakte.
Die entsprechende Messtechnik ist relativ simpel, aber leider auch sehr unzuverlässig. Die gemessenen Werte hängen von der manuellen Positionierung der Elektroden ab und die Elektrodengeometrie führt zu einer inhomogenen elektrischen Feldverteilung. Dies führt zu einer grundsätzlichen Überschätzung der Widerstandswerte.
Hinzu kommt, dass man die Zellkulturen für die Messungen aus dem Inkubator entnehmen muss. Die damit verbundenen wiederholten Störungen der physiologischen Bedingungen können das eigentliche Experiment erheblich beeinflussen. Zudem ist diese Methode zeit- und arbeitsintensiv, so dass größere, parallele Ansätze kaum realisierbar sind.
Da wir diese Nachteile nicht hinnehmen wollten, haben wir uns eine neue, störungsfreie Methode ausgedacht, mit der man den elektrischen Widerstand von Zellschichten sowie deren Kapazität messen kann. Unser Ziel war, die Zellkulturen bereits in der Wachstums- und Differenzierungsphase nichtinvasiv und ohne Marker analysieren zu können. Zusätzlich sollte uns die Methode ermöglichen, nach Erreichen der Konfluenz weitere Experimente ohne Unterbrechung des Messablaufs durchzuführen.
Unsere Arbeit mündete schließlich in einem mittlerweile kommerziell erhältlichen, computergesteuerten Laborgerät, namens cellsZscope, mit dem man bis zu 24 Zellkulturen parallel analysieren kann (J. Wegener
et al., (2004),
Biotechniques, 37 , 590-59). Hierzu werden die Zellen auf den permeablen Membranen von Standard-Zellkultureinsätzen im cellZscope kultiviert. Dabei bleibt die basolaterale Seite der Zellschichten während des gesamten Experiments voll zugänglich. Außerdem lassen sich so auch Co-Kulturen herstellen, bei denen man einen zweiten, komplementären Zelltyp auf der Membranunterseite kultiviert.
Die in dem Gerät integrierten Edelstahlelektroden sind fest positioniert und liefern ein homogenes elektrische Feld. Die Steuereinheit verbleibt außerhalb des Brutschranks und ist mit der Messeinheit durch ein flaches Kabel verbunden, das einfach durch die geschlossene Inkubatortür nach außen geführt wird, ohne dass Modifikationen erforderlich sind.
Als besonders relevanten Messparameter liefert das Gerät den transendothelialen elektrischen Widerstand (TEER) in Ω · cm
2. Ein hoher elektrischer Widerstand steht für eine niedrige ionische Permeabilität und gibt die Güte der Barriere wieder. Die von uns kultivierten primären Endothelzellen der Blut-Hirn-Schranke erreichen sehr hohe Widerstandswerte von bis zu 2000 Ω · cm
2. Dagegen zeigen immortalisierte Zelllinien der Blut-Hirn-Schranke teilweise Widerstandswerte von nur 20 Ω · cm
2. Sie sind also sehr permeabel und nur bedingt als Kulturmodell für die Blut-Hirn-Schranke geeignet.
Impedanzspektren
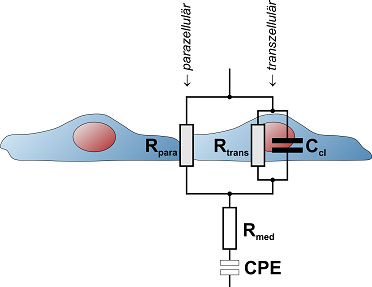
Durch Anlegen einer kleinen Wechselspannung, die für die Zellen unschädlich ist, zeigt das cellZcope den Wechselstromwiderstand beziehungsweise die elektrische Impedanz Z an. Misst man die Impedanz in Abhängigkeit von der Frequenz der Wechselspannung, erhält man ein Impedanzspektrum. Dieses liefert nicht nur Informationen zum transendothelialen (oder transepithelialen) elektrischen Widerstand, sondern auch zur elektrischen Kapazität der Zellschicht.
Beide Messparameter werden auf Basis eines Ersatzschaltbilds und entsprechender Auswertungsalgorithmen vollautomatisch aus den gemessenen Impedanzspektren extrahiert und als Funktion der Zeit aufgezeichnet. Neben TEER stellt die Kapazität der Zellschicht gerade bei Epithelzellen eine interessante Messgröße dar, da sie abhängig von der zellulären Oberflächenmorphologie ist und somit unter anderem Rückschlüsse auf die Ausprägung von Mikrovilli zulässt.
Ist der Experimentator an weiteren Informationen interessiert, kann er Daten zur Elektrodenkapazität und zum Elektrolytwiderstand von der Gerätesoftware ausgeben lassen. Grundsätzlich werden sämtliche Messgrößen in entsprechenden physikalischen Einheiten zur Verfügung gestellt, so dass jederzeit eine umfangreiche Interpretation der Daten möglich ist. In der Regel konzentriert sich das Interesse auf den TEER-Wert, der ein Maß für die Dichtigkeit des parazellulären Weges zwischen den Zellen durch die Tight Junctions hindurch ist.
Wer hat Eintritt?
Wie oben erwähnt ist unser primäres Arbeitsgebiet die Blut-Hirn-Schranke. Dabei interessieren wir uns für die Ausbildung der Barriere unter dem Einfluss von Glucocorticoiden, Serumbestandteilen, der extrazellulären Matrix, von Matrixmetalloproteinasen oder Wachstumsfaktoren.
Auch Nanopartikel können als Vehikel zum Transport über die Blut-Hirn-Schranke dienen. So konnten wir kürzlich mit Impedanzmessungen nachweisen, dass bestimmte Nanopartikel in der Lage sind, die Barriere kurzzeitig zu öffnen (R.Rempe
et al., (2011)
Biochem. Biophys. Res. Commun. 406, 64-69). Dieser Prozess ähnelt einer Entzündungsreaktion am Endothel, bei der zum Beispiel Entzündungszellen unter Erhalt der Tight Junctions durch den Zellkörper migrieren (M.von Wedel-Parlow
et. al., (2011).
Brain Res. 1367, 62-76).
Auch bei der Untersuchung des Enzym-Transfers über die Blut-Hirn-Schranke setzen wir die Impedanzmessung mit dem cellZscope ein. Unsere Studienobjekte sind hier lysosomale Enzyme, die unter anderem für den Abbau sulfatierter Lipide verantwortlich sind. Fehlen diese Enzyme in den Hirnzellen, kommt es zu neurodegenerativen Erkrankungen. Bei einer möglichen Enzymersatztherapie verhindert die Blut-Hirn-Schranke den effektiven Transfer exogen verabreichter Enzyme. Mit Hilfe unseres Zellkultursystem und des cellZscopes versuchen wir, die Transfereffizienz durch Modifikation der Enzyme zu erhöhen, ohne dabei deren Funktion zu beeinträchtigen.
Letzte Änderungen: 14.09.2011