Einzelmolekül Spektroskopie
von Harald Zähringer (Laborjournal-Ausgabe 01, 2002)
Als der Nobelpreisträger Richard Feynman 1959 von der physikalischen Möglichkeit sprach, Materie auf molekularer oder atomarer Ebene zu manipulieren, galt er noch als Visionär. 40 Jahre nach seiner historischen Rede sind dank revolutionärer Erfindungen in den 70er und 80er Jahren, Experimente an Einzelatomen oder -molekülen in vielen Labors bereits Routine. So messen Wissenschaftler mit Patch Clamp-Elektroden Ströme an einzelnen lonenkanälen oder sie tasten mit verschiedenen Rastersondentechniken, wie der Rastertunnel- oder der Rasterkraftmikroskopie, Oberflächenatome ab. Etwas jünger, aber bereits auf dem Besten Weg flügge zu werden ist eine weitere dieser Einzelmolekültechniken, die gerade für biologische Anwendungen äußerst interessant ist: die Einzelmolekülspektroskopie (EMS).
Die Anfinge der EMS gehen zurück in das Jahr 1976. Damals wies der Amerikaner Thomas Hirschfeld einzelne Antikörper spektroskopisch nach. Allerdings musste er diese mit mehr als 80 Fluorophoren beladen, damit sie ausreichend fluoreszierten, wenn er sie anstrahlte. Bei der EMS war Hirschfeld zwar noch nicht angelangt. Dennoch legte er mit seinen Arbeiten die Grundlagen für die Einzelmolekül-Fluoreszenzspektroskopie (EMFS), die sich inzwischen zur wichtigsten EMS-Technik mauserte. 1990 gelang Richard Keller in Los Alamos mit der EMFS schließlich der erste spektroskopische Nachweis eines einzelnen Fluorophors.
Das Prinzip der EMFS ist relativ einfach: An die Substanz, die untersucht werden soll, wird zunächst ein Fluoreszenzfarbstoff etwa Rhodamin, Cyanin oder Cy5 kovalent angeheftet. Der Farbstoff wird dann unter einem Mikroskop mit Laserlichtpulsen zur Fluoreszenz angeregt, die eine angeschlossenen Kamera registriert. Verschiedene Fluoreszenz-Parameter, etwa Lebensdauer, Quantenausbeute oder Intensitäts-Schwankungen, liefern Informationen zur chemischen Umgebung oder räumlichen Orientierung der Fluorophore.
Biologen und Biophysiker nutzen meist konventionelle Epi-Fluoroszenz Mikroskope für ihre EMFS-Experimente. Als Strahlenquellen dienen Farbstoff-Laser mit Wellenlängen von 600 bis 650 Nanometer, die ein Probenareal von 20 bis 100 µm2 durchfluten. Die Fluoreszenz-Signale fängt eine mit flüssigem Stickstoff gekühlte CCD-Karnera ein, die sie an einen Computer zur Auswertung weiterleitet. Diese so genannte Weitfeld-Mikroskopie ist besonders geeignet, einzelne Biomoleküle in einer Zelle aufzuspüren, und ihren weiteren Weg darin zu verfolgen. Sobald nämlich ein markiertes Molekül durch das Volumen marschiert, das der Lichstrahl des Lasers ausleuchtet, blinkt es kurz auf und gibt so neben Identität und Aufenthaltsort über den Diffusionskoeffizienten, auch die eingeschlagene Richtung und die Art der Fortbewegung preis. Die Moleküle können sich also nicht mehr in der Anonymität eines Molekülensembles verstecken.
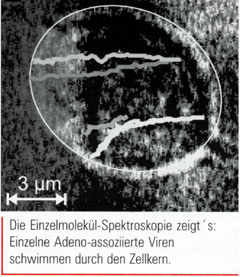
Mit dieser Technik konnten die Mitarbeiter von Christoph Bräuchle und Michael Hallek, die im "Centre for NanoScience" beziehungsweise dem Genzentrum der LMU München arbeiten, zum ersten Mal den Infektionsweg eines einzelnen Adeno-assozierten Virus (AAV) auf Video-Film bannen (Science 294, S. 1929). Dazu schmückten sie die AA-Viren zunächst mit ein bis zwei Cy5-Fluorophoren bevor sie 10 bis 1000 der fluoreszierenden Viren auf jede einzelne Zelle einer HeLa-Zellkultur losließen. Anschließend richteten sie ihren Suchscheinwerfer in Zeitabständen von 40 Millisekunden auf eine dieser Hela-Zellen, projizierten die Fluoreszenz-Signale in eine Ebene und setzten die Bilder schließlich zu einem Video-Clip zusammen.
Auf diesem ist teilweise Verblüffendes zu sehen: So klopft das AA-Virus zunächst fünf mal an der Zellmembran an, bevor ein Endosom das Virus umschließt und durch die Membran geleitet. Nach einigem Hin und Her springt es dann offensichtlich auf Motorproteine wie Kinesin oder Dynein auf, die es entlang der Mikrotubuli-Schienen in Richtung Zellkern transportieren. Zur Überraschung von Bräuchles Team wandert das Virus auch im Bereich des Nukleoplasmas, in dem sich weder Motorproteine noch Mikrotubuli befinden, schnurstracks auf den Kern zu. Schon 15 Minuten, nachdem die Viren die HeLa-Zellen enterten, entdeckte Bräuchles Videokamera bereits bei der Hälfte der HeLa-Zellen das erste Virus im Zellkern.
Kein Entkommen für Tumormarker
Auch in Österreich richtet eine Arbeitsgruppe ihren EMFS-Laser auf lebende Zellen. Gerhard Schütz vom Linzer Institut für Biophysik untersuchte mit der EMFS etwa die Mikrodomänen der Zellplasmamembran. Dazu markierte er ausgesuchte Phospholipide mit Cy5, präparierte daraus Lipid-Vesikel und mischte sie mit Kulturen von Arterienzellen des Menschen. Den Transfer des Cy5-Lipids in die Membran der Arterienzellen und deren weiteren Weg innerhalb der Lipid-Doppelschicht verfolgte er dann mit einer EMFS-Kamera (EMB-Journal 19, S. 892).
Markus Sauer dagegen vom Physikalisch-Chemischen Institut der Universität Heidelberg entwickelte mittels EMFS einen Nachweis für Brusttumor-Marker. Dazu fängt er Antikörper, die das Immunsystem gegen das unterglykosylierte, brustkrebsassozierte Protein MUC1 bildet, mit kurzen fluoreszierenden Peptiden aus MUC1-Epitopen ein, die zusätzlich ein positiv geladenes Arginin-Anhängsel tragen. Binden die Peptid-Sonden MUC1-Antikörper, so kompensiert die negative Ladung des Antikörpers die positive der Sonden. In einem elektrischen Feld trennt Sauer schließlich die gebundenen von den freien Peptiden und kann dann am Plus-Pol über die fluoreszierenden Sonden selbst einzelne MUC1-Antikörper mit der EMFS aufspüren.
Die EMFS ist also auch für analytische Zwecke bestens geeignet.
Letzte Änderungen: 20.10.2004