Frostige Schnappschüsse
(10.2.2015) Mithilfe von Kryoelektronentomographie gelang es Wissenschaftlern aus Martinsried und Kaiserslautern, dreidimensionale Abbildungen von Ribosomen in intakten Hefe-Mitochondrien zu erzeugen.
Mitochondriale Ribosomen oder Mitoribosomen sind vor allem für die Herstellung von hydrophoben Membranproteinen für die Atmungskette und die ATP-Synthese zuständig. Diese Proteine werden bereits während ihrer Translation in die innere Mitochondrienmembran eingefügt. Ein Forscherteam vom Max Planck Institut für Biochemie in Martinsried und von der Technischen Universität Kaiserslautern um den Physiker Friedrich Förster konnte zeigen, dass die meisten Mitoribosomen unmittelbar an der inneren Mitochondrienmembran sitzen, vermutlich als Polysomen, also zu mehreren auf einem mRNA-Molekül (Nat. Commun. 6:6019).
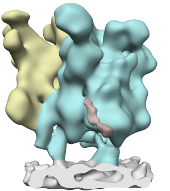
Die Wissenschaftler fanden, dass die 54S Untereinheit der Mitoribosomen an zwei Stellen in direktem Kontakt mit der inneren Mitochondrienmembran steht. Ein Ribosomenfüßchen bindet über eine Schleife der ribosomalen 21S rRNA an die Membran, das andere Ribosomenfüßchen interagiert mit dem Membranprotein Mba1. Letzteres kommt dadurch direkt gegenüber dem ribosomalen Proteinaustrittstunnel zu liegen und kann mit entstehenden Polypeptidketten chemisch quervernetzt werden. Höchstwahrscheinlich ist es zusammen mit seinem Interaktionspartner, der Oxa1-Insertase, auch für das Einfädeln neuer Proteine in die innere Mitochondrienmembran zuständig.
Gestochen scharfe Bilder
Um ihre Proben für die kryoelekronentomographischen Untersuchungen vorzubereiten, kühlten die Forscher isolierte Hefe-Mitochondrien extrem schnell auf unter minus 170 °C ab. Dabei erstarren diese in einem glasartigen Zustand und biologische Strukturen bleiben intakt. „In einem Transmissionselektronenmikroskop haben wir die Mitochondrien dann aus verschiedenen Winkeln abgebildet und anschließend, ähnlich wie bei einer medizinischen Computertomographie, dreidimensional rekonstruiert“, erläutert Förster. Dabei kamen den Wissenschaftlern auch Weiterentwicklungen der Kameratechnologie zugute. Mithilfe schneller und empfindlicher Elektronen-Direktdetektoren lassen sich biologische Makromoleküle nun in ihrer nativen Umgebung mit einer Auflösung im Nanometerbereich und darunter abbilden. Dazu müssen Tausende von elektronenmikroskopischen Aufnahmen ausgewertet werden (Science 343:1443-1444).
„Die Methode eignet sich insbesondere zur Untersuchung von Molekülen in Lipidmembranen und von flexiblen und fragilen makromolekularen Komplexen“, erklärt der Seniorautor. Försters Arbeitsgruppe, die sich mit der Modellierung von Proteinkomplexen beschäftigt, entwickelte auch Software zur Auswertung der Aufnahmen. Mit dem bisherigen elektronenmikroskopischen Equipment war es schwierig, Ribosomen in den Mitochondrien strukturell zu untersuchen, da sich die proteinreichen Makromoleküle kaum vom ebenfalls proteinreichen Inneren der Mitochondrien abheben.
Viele offene Fragen
Das Gen für das Mba1-Protein, das 2006 erstmals als Ribosomenrezeptor beschrieben wurde (EMBO J. 25:1603-1610), sitzt im Zellkern. Mba1 wird im Zytosol gebildet und anschließend in die Mitochondrien transportiert. „Woraus das für Mba1 kodierende Gen im Laufe der Eukaryonten-Evolution entstanden ist, ist nicht bekannt“, erklärt Mitautor Johannes Herrmann von der Technischen Universität Kaiserslautern. Ebenfalls noch unklar ist, auf welche Weise die Schleife der 21S rRNA an die innere Mitochondrienmembran andockt. In Frage kommen Wechselwirkungen zwischen den negativ geladenen Phosphatgruppen der rRNA und positiv geladenenen Kopfgruppen von Phospholipiden der Membran. Möglicherweise bindet die 21S rRNA auch an ein Protein der inneren Mitochondrienmembran.
Förster hat aber noch weitere interessante Projekte auf Lager. „Wir haben zwischen den Hefe-Mitoribosomen Verbindungsstrukturen entdeckt. Diese wollen wir nun genauer untersuchen und ihre Funktion aufklären”, erläutert er. Der Wissenschaftler vermutet, dass diese Strukturen die an den Mitoribosomen gebundenen mRNAs vor oxidativen Schäden schützen. Solche Schädigungen an mitochondrialen Komponenten tragen zum Alterungsprozess bei. Die in der Hefe gewonnenen Ergebnisse lassen sich jedoch nicht ohne weiteres auf tierische Mitoribosomen übertragen. „Letztere sind etwas kleiner, da ihre rRNA verkürzt ist. Deshalb wissen wir nicht, ob der durch rRNA vermittelte Kontakt zwischen Mitoribosomen und der inneren Mitochondrienmembran auch bei Tieren zu finden ist”, kommentieren die Forscher.
Bettina Dupont
Abb.: Friedrich Förster/MPI für Biochemie
(Mitoribosom an der inneren Mitochondrienmembran, rot: wachsende Polypeptidkette)