Drei auf einen Streich: die Life Science Wochenschau (6)
(5.3.16) Zum Wochenende gibt es wieder drei besondere Fundstücke aus dem Forschungsticker.
Sympatrische Artbildung im Bodensee?
Populationen des dreistachligen Stichlings im und um den Bodensee unterscheiden sich morphologisch und genetisch deutlich voneinander. Berner Wissenschaftler um Ole Seehausen sehen darin Hinweise auf einen sympatrischen Artbildungsprozess, also eine Aufspaltung in reproduktiv getrennte Gruppen, ohne dass es Barrieren zwischen den Populationen gibt:
"Statt eines einzigen «Bodenseestichlings» haben sie nämlich unterschiedliche Formen gefunden, die einerseits typisch sind für den See und andererseits für die Seezuflüsse. Und dies, obwohl auch die Stichlinge aus dem See zur Laichzeit in die kleinen Zuflüsse wandern. «Es war völlig unerwartet, dass sich die Stichlinge in so kurzer Zeit auseinander entwickeln, wenn sie sich doch zur gleichen Zeit und an denselben Orten paaren», sagt David Marques, der Erstautor der Studie, die Teil seiner Doktorarbeit ist. Üblicherweise entwickeln sich eigenständige Arten, indem sie sich an unterschiedliche Lebensräume anpassen und sich räumlich voneinander isoliert fortpflanzen, im See zum Beispiel in verschiedenen Tiefen.
Die Beobachtung einer Artbildung, wie sie sich zurzeit bei den Stichlingen anbahnt, ist für die beteiligten Forscher faszinierend. Möglich wurde sie erst in den letzten Jahren, dank des technischen Fortschritts in der DNA-Sequenzierung. Rund 40 Regionen auf 20 verschiedenen Chromosomen haben die Wissenschaftler identifiziert, wo sich die «Seestichlinge» von den «Bachstichlingen» unterscheiden."
Komplette Pressemitteilung hier.
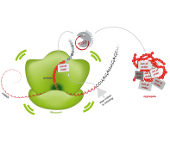 So entstehen Proteinklumpen
So entstehen Proteinklumpen
Proteinaggregate spielen offenbar eine Rolle bei Nervenerkrankungen wie Alzheimer oder Huntington. Martinsrieder Max-Planck-Forscher um Ulrich Hartl haben jetzt einen Mechanismus beschrieben, wie Proteine verklumpen, und wie diese Klumpen die Zelle dabei beschädigen können:
"In gesunden Zellen gibt es bei der Proteinherstellung eine sehr effiziente Qualitätskontrolle. Fehlgefaltete und nutzlose Proteine werden markiert, repariert oder zügig abgebaut. Ein wichtiger Bestandteil der Qualitätskontrolle ist Ltn1p. „Ist Ltn1p in krankhaft veränderten Zellen nicht aktiv oder fehlen andere Bestandteile der Qualitätskontrolle, reichern sich fehlerhafte Proteine im Zellinneren an, sie verklumpen“, sagt [Ko-Erstautor] Sae-Hun Park .
Welche fatalen Folgen das Versagen der Qualitätskontrolle haben kann, konnte bereits im Mausmodell gezeigt werden. Tiere mit einer entsprechenden Mutation zeigen Symptome von fortschreitender Neurodegeneration und eingeschränkter Bewegungsfähigkeit.
Entstandene Proteinaggregate haben klebrige Eigenschaften und wirken wie ein Kristallisationskeim. Sie binden schließlich auch fehlerfrei funktionierende und für die Zelle lebensnotwendige Proteine an sich."
Abbildung: "Ist die Proteinbauanleitung (mRNA), defekt, werden in den Ribosomen nutzlose Proteine hergestellt. Ist die Qualitätskontrolle nicht aktiv, reichern sich diese Proteine an und verklumpen zu Aggregaten"
Illustration: © MPI für Biochemie
Komplette Pressemitteilung hier.
 Bodyguards für die Nerven
Bodyguards für die Nerven
Forscher des Bonner Universitätsklinikums um Schoch McGovern haben einen "molekularen Leibwächter" entdeckt, der Nervenzellen vor dem Tod durch Übererregung bewahrt:
"Werden Nervenzellen überstark erregt, so gehen sie häufig zugrunde. Dies beobachten Mediziner oft als Folge eines epileptischen Anfalls. Eine Ursache solch übersteigerter Aktivierung ist häufig eine zu starke Ausschüttung des Botenstoffs Glutamat. Dieser Neurotransmitter kann Signalwege anschalten, die auf Nervenzellen toxisch wirken“, sagt Prof. Dr. Schoch McGovern vom Institut für Neuropathologie und der Klinik für Epileptologie des Universitätsklinikums Bonn. Allerdings versuchen die Gehirnzellen, sich davor zu schützen und einer gefährlichen Übererregung vorzubeugen.
Welche Art von „molekularen Bodyguards“ hier aktiv werden, ist noch nicht genau geklärt. Aus wissenschaftlichen Studien ist jedoch bekannt, dass Transkriptionsfaktoren für den Selbstschutz von Nervenzellen eine wichtige Rolle spielen. Diese Faktoren schalten bestimmte Gene an, die dann über Signalketten zur Produktion von Schutzstoffen führen. Letztere wirken der gefährlichen Glutamat-Übererregung effektiv entgegen.
Das Forscherteam um Prof. Dr. Schoch McGovern konnte nun zeigen, dass ein Gen für das Sensorprotein Synaptotagmin 10 (Syt10) einen solchen Schutzschild darstellt. Erleiden zum Beispiel Ratten einen epileptischen Anfall, so steigt die Menge an Syt10 in der Hirnregion des Hippocampus deutlich an. "
Komplette Pressemitteilung hier.
Foto: Karen van Loo, Prof. Dr. Susanne Schoch McGovern und Johannes Alexander Müller vom Institut für Neuropathologie und der Klinik für Epileptologie des Universitätsklinikums Bonn. © Volker Lannert/Uni Bonn









 So entstehen Proteinklumpen
So entstehen Proteinklumpen Bodyguards für die Nerven
Bodyguards für die Nerven